Autor: Adolfo Martínez Palomo*
EL PROTOZOARIO Entamoeba histolytica es una de las más primitivas células eucariontes. La forma móvil, o trofozoíto, se diferencia de los procariontes —como las bacterias, organismos sin núcleo, con organización citoplásmica mal definida, genoma pequeño y superficie celular estratificada— por tener núcleo organizado, genoma complejo y superficie constituida por una sola membrana plasmática. Si bien estas últimas son características de los eucariontes, las amibas se distinguen también de éstos por su organización citoplásmica rudimentaria y división nuclear sin cromosomas evidentes. Nos encontramos pues ante un eucarionte rudimentario.
La actividad dinámica y el pleomorfismo de los trofozoítos están basados en una configuración citoplásmica más fácil de definir por sus carencias que por sus semejanzas, en comparación a las células eucariónticas típicas. Así, las amibas no tienen citoesqueleto estructurado (el sistema de delicados microfilamentos y microtúbulos responsable del mantenimiento de la forma y la movilidad de las células eucariónticas); no disponen tampoco de un sistema membranal equivalente al complejo de Golgi y al retículo endoplásmico (sistemas encargados de la síntesis, movilización, empaquetamiento y liberación de proteínas y glucoproteínas); las mitocondrias (productoras de compuestos ricos en energía, necesarios para el metabolismo de las células eucariontes) brillan por su ausencia en las amibas y, finalmente, éstas carecen de un sistema de lisosomas primarios y secundarios (organillos celulares encargados de la degradación de componentes intra o extracelulares de los eucariontes típicos).
La amiba: pequeña pero temible
A pesar de esta simplicidad —o gracias a ella— estos pequeños protozoarios, apenas cuatro o cinco veces mayores que un glóbulo rojo; extremadamente frágiles y sumamente sensibles a cambios de temperatura, son capaces de colonizar el intestino grueso de una buena proporción de la población mundial. Además, bajo circunstancias que aún no conocemos, pueden invadir la mucosa intestinal y, eventualmente, destruir todos los tejidos del cuerpo humano; desde los recubrimientos epiteliales y los órganos sólidos, hasta tejidos como el cartílago y el hueso. Al mismo tiempo, el parásito invasor evade exitosamente los mecanismos moleculares y celulares de defensa del huésped humano y encuentra las condiciones necesarias para su multiplicación. En esos casos, a menos de que sean eliminadas por drogas eficientes, las frágiles amibas continuarán su efecto destructor, hasta que el huésped muera, junto con los parásitos. Los trofozoítos tienen capacidad invasora, pero no logran sobrevivir fuera del organismo humano, por lo que no tienen capacidad de transmitir la enfermedad. Por ello, una infección invasora es, desde el punto de vista biológico, un suicidio colectivo para las amibas.
Como parte del interés renovado en la biología de las enfermedades parasitarias, y gracias a la disponibilidad de cultivos axénicos, esto es, cultivos en los que las amibas crecen sin asociación con bacterias o con otros protozoarios, numerosos laboratorios han analizado amibas bajo el microscopio electrónico, han desmenuzado al parásito en múltiples fracciones para caracterizar sus componentes químicos y han estudiado la naturaleza de sus componentes antigénicos.
Esta actividad febril ha producido, hasta ahora, resultados que podemos calificar de discretos. Los neófitos en la experimentación con amibas deben superar —en ocasiones sólo lo intentan infructuosamente— algunos de los siguientes problemas:
La aparente simplicidad estructural de la organización citoplásmica de las amibas hace que el sólido conocimiento de que disponemos sobre la biología celular de eucariontes típicos sea casi inutilizable para la comprensión de la biología del parásito; los componentes amibianos aislados se degradan por sus componentes proteasas; algunas moléculas del suero se adsorben a la superficie de las células y complican por ello la caracterización bioquímica; la fragilidad de las amibas limita de forma sensible su manipulación y, finalmente, los cultivos son muy susceptibles a variaciones en los componentes del medio de cultivo.
La consecuencia de esos problemas es que a pesar de haber transcurrido una década de estudios intensos, el conocimiento de la biología celular del parásito es todavía incipiente. No se han explorado las bases moleculares y celulares de procesos como la diferenciación de trofozoíto a quiste, el cambio de comensal inocuo a invasor dañino, los mecanismos de evasión de la respuesta inmune del huésped y los cambios celulares que ocurren durante la división nuclear. Sin embargo, la información adquirida durante la última década nos permite, no tan sólo tener idea más precisa de la estructura, organización y funciones del parásito, sino también empezar a comprender mejor la amibiasis.
Así como la organización del citoplasma es sencilla, el ciclo de vida de la Entamoeba histolytica es igualmente simple. Los trofozoítos viven, se alimentan y se multiplican en el intestino grueso del hombre, actuando como respetuosos comensales; se diferencian en quistes al cubrirse con gruesa y resistente pared, misma que les permite sobrevivir en el exterior. Cuando una persona ingiere alimentos o agua contaminados con quistes, éstos penetran al tubo digestivo y al llegar al colon se liberan de la pared quística para adoptar de nueva cuenta la forma de trofozoíto. No se requieren huéspedes intermediarios y, al parecer, el único huésped definitivo es el ser humano (Figuras 9, 10).
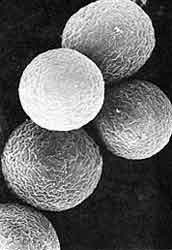 |
| Figura 9. Fotomicrografía electrónica de barrido de quistes de Entamoeba histolytica. |
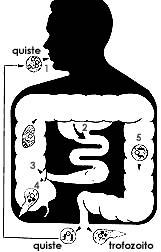 |
| Figura 10. Esquema simplificado del ciclo de vida de la Entamoeba histolytica. |
La simplicidad estructural resalta al examinar trofozoítos con el microscopio de luz, ya sea de parásitos obtenidos de pacientes con disentería, o bien de amibas cultivadas. En los parásitos teñidos con colorantes, destacan, sobre todo, el núcleo y numerosas vacuolas citoplásmicas. El núcleo, en cambio, no es aparente en amibas vivas examinadas sin teñir; en estas condiciones son la movilidad de las células y la formación de prolongaciones o seudópodos de apariencia lisa y homogénea, lo que se aprecia al examen microscópico.
Retrato hablado del agresor
La movilidad de los componentes citoplásmicos de la amiba, su desplazamiento relativamente rápido sobre el substrato, la explosiva formación de seudópodos y la voraz capacidad de ingerir partículas y células de todo tipo que se encuentren en su camino, constituyen los atributos más llamativos de las amibas patógenas al escudriñarlas bajo el microscopio. Ese conjunto de funciones, dependientes todas de la movilidad del parásito, ha estimulado el estudio de los componentes moleculares responsables de la notable actividad dinámica. Bajo el microscopio electrónico, la simplicidad estructural de las amibas (Figura 11) se refleja en la ausencia de microfilamentos y microtúbulos; en regiones como los seudópodos o las zonas de fagocitosis, donde se concentra la actina —proteína contráctil presente en todas las células animales— el examen ultramicroscópico sólo muestra ausencia de vacuolas y, cuando las condiciones de fijación son adecuadas, la concentración en esas áreas de material fibrogranular. Ha sido motivo de sorpresa y frustración a la vez, averiguar la falta de organización estructural de las proteínas contráctiles de una de las células dotadas de mayor movilidad y plasticidad.
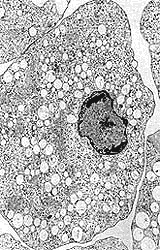 |
| Figura 11. Fotomicrografía electrónica de transmisión de un trofozoíto de Entamoeba histolytica. |
Los filamentos estructurados, fácilmente visibles en las células eucariónticas mejor desarrolladas, sólo aparecen excepcionalmente en las amibas; la actina de éstas ha sido caracterizada bioquímicamente hasta hace poco por Meza y colaboradores. Han encontrado que, en general, esta proteína es semejante a la actina de otros eucariontes, excepto por variaciones pequeñas en la composición de polipéptidos; la actina amibiana tiene propiedades que la diferencian de la mayoría de las actinas y la hacen particularmente interesante en estudios de movilidad en eucariontes.
Desconocemos la naturaleza de otras moléculas que seguramente intervienen en el movimiento de las amibas; asimismo, ignoramos los mecanismos que disparan en un momento dado la acumulación de moléculas contráctiles en una región de la célula y determinan el resultado como la formación de un seudópodo, requerido para la traslación, o de regiones especializadas de la superficie celular que permiten la captación de material extracelular hacia el citoplasma amibiano, durante el proceso de fagocitosis. Estos procesos, en apariencia simples, requieren en realidad la sucesión de fenómenos tales como: reconocimiento en la membrana plasmática, paso de la señal recibida en la superficie al citoplasma, acumulación y polimerización focal de moléculas contráctiles, contracción de estas últimas en forma coordinada y con direccionalidad específica y, por último, vuelta a la organización citoplásmica local previa a la realización del fenómeno.
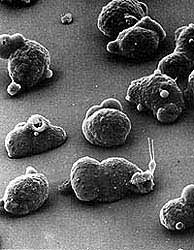 |
| Figura 12. Fotomicrografía electrónica de barrido de amibas patógenas en cultivo. |
Además de la movilidad, es el pleomorfismo de las amibas una de las características más llamativas del parásito. Ninguna técnica muestra mejor esta variación en la forma que la microscopía electrónica de barrido (Figura 12). Con ella, se aprecian diferencias no solamente entre especies, sino también, entre amibas de la misma especie. La siempre cambiante superficie amibiana puede presentar seudópodos, estomas de fagocitosis, prolongaciones filiformes que las unen al substrato, y un uroide o extremo caudal. La superficie basal de los trofozoítos en contacto con células blanco, a través de la cual se realiza tanto la adhesión como la lisis de estas últimas, no muestra diferenciaciones notables, excepto por la presencia de filópodos cortos en el margen externo del parásito, posiblemente involucrados en la adhesión. La microscopía electrónica de barrido podrá, tal vez, ofrecer información valiosa respecto a las diferencias estructurales entre amibas patógenas y no patógenas; la imposibilidad de cultivar en condiciones axénicas amibas de portadores asintomáticos ha retrasado ese estudio, de posible utilidad taxonómica.
Las amibas se adhieren
La ingestión de células o de material particulado por las amibas se inicia con el fenómeno de adhesión (Figura 13). Los trofozoítos se adhieren a casi todas las células en cultivo y a la gran mayoría de los substratos naturales o inertes empleados, entre los que se cuentan plástico, vidrio, colágena y albúmina. La adhesión a un substrato plano provoca modificación en la forma de las células, en lo que parece un intento fallido de ingerir al substrato; se forma en las regiones de adhesión una banda de material fibrogranular, rico en actina; drogas como la citocalasina B, que alteran la polimerización de las moléculas de actina, interfieren considerablemente con el fenómeno de adhesión, que tampoco puede llevarse a cabo en frío. Al parecer, la adhesión involucra tanto mecanismos inespecíficos como específicos. Los primeros intervienen en la adhesión a superficies inertes, mientras que los segundos participan en la adhesión de las amibas a células del huésped, a través de la interacción de moléculas presentes tanto en la superficie del parásito como en las células del huésped. A diferencia de las bacterias productoras de alteraciones de la mucosa intestinal en las que ciertas moléculas, al facilitar la adhesión —adhesinas— determinan en buena parte la virulencia de esos organismos, en las amibas no parece haber diferencias en la capacidad de adhesión en cepas con virulencia diferente. Los estudios bioquímicos han mostrado la existencia de una lectina amibiana, o sea, una proteína que reconoce carbohidratos específicos en la superficie de las células blanco; ésta, sin embargo, es la misma y se encuentra en concentraciones iguales en amibas patógenas y no patógenas.
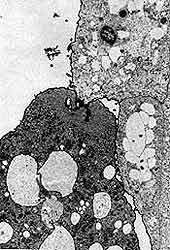 |
| Figura 13. Una amiba en contacto con una célula epitelial, vista con el microscopio electrónico de transmisión. |
Las amibas ingieren
Una excelente forma de analizar tanto la adhesión como la fagocitosis (Figura 14) de las amibas patógenas, es ponerlas en contacto con glóbulos rojos humanos. Es bien sabido que, en el laboratorio clínico, la prueba más contundente de la culpabilidad amibiana en un caso de disentería es la presencia de amibas hematófagas en heces, es decir, amibas que han ingerido glóbulos rojos del huésped a través del fenómeno de fagocitosis. Se trata de un modelo experimental muy sencillo pero útil para comprender algunas de las funciones de las que depende la acción patógena del protozoario. Al entrar en contacto con los glóbulos rojos, algunos son internalizados sin dilación, pero otros muchos forman cúmulos en el extremo posterior de la amiba, posiblemente como resultado de la liberación de la lectina amibiana. No parece haber un sitio específico en el que se lleve a cabo la ingestión; cualquier región de la superficie de la amiba puede, en un momento dado, formar un estoma (boca) de fagocitosis e iniciar el proceso de ingestión de eritrocitos. Otras células fagocíticas, tales como los glóbulos blancos (leucocitos polimorfonucleares) y los macrófagos, realizan la fagocitosis a través de la formación de grandes prolongaciones citoplásmicas que rodean a la célula por ingerir hasta envolverla por completo; al tocarse los bordes de las prolongaciones la célula queda en el interior del fagocito. En cambio, en el caso de las amibas patógenas, la fagocitosis ocurre mediante un curioso fenómeno de succión: las células, en el caso que comentamos los glóbulos rojos, entran por succión al interior de la amiba a través de estrechos canales, lo que produce una deformación considerable de la célula blanco durante la ingestión. En ocasiones, las amibas succionan toda una célula; en otra, es sólo una porción la que es fagocitada; en este último caso, al cerrarse el canal la célula blanco se rompe, por lo que queda una porción dentro y permanece fuera el resto.
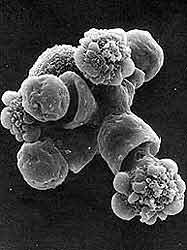 |
| Figura 14. Una amiba fagocitando simultáneamiente media docena de células epiteliales, vistas al microscopio electrónico de barrido. |
Un vistazo bioquímico a las amibas
Ya hemos mencionado que la fagocitosis debe, necesariamente, llevarse a cabo por concentración y ordenación de moléculas contráctiles, entre ellas la actina, pero que nada sabemos sobre los mecanismos que regulan el fenómeno, del que, como veremos más adelante, depende en buena medida la virulencia de las amibas patógenas.
La superficie de las amibas contiene una membrana plasmática, con la clásica apariencia trilaminar, pero más gruesa que las membranas plasmáticas de mamíferos. Los lípidos que la constituyen son también diferentes cualitativa y cuantitativamente de los presentes en células de mamífero, lo que podría explicar dos propiedades coexistentes y aparentemente contradictorias: la gran plasticidad y la notable estabilidad de las membranas amibianas. Además, esa composición peculiar podría hacer que las amibas sean más resistentes a la acción tanto de la enzimas del tubo digestivo, como de las que libera el parásito para producir la muerte de las células que destruye, cuando deja de ser plácido comensal.
La mayor parte de las proteínas de la membrana plasmática son glucoproteínas; de ellas se han podido diferenciar más de una docena. Los carbohidratos de superficie forman una delicada cubierta de superficie, visible en el microscopio electrónico de transmisión. Esta técnica nos permitió revelar la propiedad de las amibas de dejar una capa fina de esa cubierta superficial a medida que se desplaza sobre un substrato; esa huella azucarada del paso de los trofozoítos llega a cubrir totalmente la superficie de los recipientes en los que se multiplica el parásito, a manera de finísimo tapete o microexudado. Esta es, tal vez, una de las argucias de las que echa mano el parásito para evadir la respuesta inmune del huésped, si ésta se dirige, inútilmente, hacia las trazas dejadas por el intruso más que hacia el invasor mismo.
Nuestros parásitos en cuestión no sólo pueden confundir al huésped dejando estelas a su paso, sino también movilizando rápidamente los inoportunos anticuerpos que lleguen hasta su cambiante superficie. Hace ya diez años describimos, junto con Trissl, lo que acontece cuando una molécula —la lectina concanavalina A— reacciona con la superficie de amibas vivas. Inicialmente, las moléculas capaces de reconocer componentes de la membrana plasmática del parásito —o ligandos— se unen uniformemente a toda la superficie celular. La interacción despierta, al parecer, un mecanismo de movilización de los componentes de la superficie celular de tal suerte que al cabo de pocos minutos los agregados formados por el ligando y el receptor —o por anticuerpos con los antígenos de membrana correspondientes— se desplazan hacia el polo posterior de la amiba y forman un casquete (Figura 15). Una vez que las amibas concentran los agregados en un punto de su superficie, éstos pueden ser liberados hacia el exterior, o bien pueden ser incorporados por el parásito para su degradación posterior. Es pues un segundo posible mecanismo de evasión de la respuesta inmune humoral.
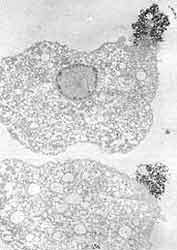 |
| Figura 15. Dos amibas después de haber estado en contacto con concanavalina A. Al cabo de 15 minutos la mayor parte de las moléculas se acumulan en el polo posterior de las amibas. Fotomicrografía electrónica de transmisión. |
La superficie de las amibas patógenas muestra otro fenómeno, hallado recientemente en nuestro laboratorio. El contacto del parásito con substratos naturales, como la colágena o la albúmina, provoca la formación y liberación de cuerpos densos. Pocas horas después de ese contacto se concentran por debajo de la membrana plasmática abundantes cuerpos de alta densidad a los electrones. Éstos se separan del cuerpo de la amiba mediante un proceso que recuerda la gemación de los virus. Finalmente, los cuerpos densos pierden la membrana que los rodea y entran en contacto con el substrato, al que aparentemente degradan. Se trata, al parecer, de un mecanismo de liberación de compuestos amibianos, entre los que bien pueden estar algunas de las toxinas y enzimas caracterizadas recientemente como amibas virulentas, en lo que sería un mecanismo de concentración y liberación de sustancias tóxicas en forma condensada. Los estudios futuros deberán aclarar con precisión la naturaleza y significado de esta reacción de la superficie amibiana ante la presencia de proteínas del huésped.
El metabolismo de las amibas patógenas, tal como podría esperarse, está adaptado al ambiente bajo en oxígeno del colon humano. Los trofozoítos no son organismos anaerobios absolutos, como se les consideraba tradicionalmente; son capaces de consumir oxígeno a pesar de la ausencia de mitocondrias y pueden crecer en atmósferas que contienen hasta 5% de oxígeno. Son aerobios facultativos, que además poseen enzimas glucolíticas peculiares, sólo encontradas previamente en ciertas bacterias. Este metabolismo peculiar puede representar una ventaja a las amibas, al permitir que el parásito cambie de la luz intestinal, con presión baja de oxígeno, al ambiente más rico en oxígeno que encuentra cuando invade órganos sólidos con vascularización abundante.
La principal fuente de energía del parásito son los carbohidratos. Esto ha hecho que numerosos autores hayan considerado en el pasado que la mayor virulencia de las amibas en ciertas poblaciones pobres se debe, precisamente, a que se nutren fundamentalmente de carbohidratos; ello exaltaría la virulencia amibiana. Experimentalmente sólo se ha podido comprobar a satisfacción que en la amibiasis experimental de animales de laboratorio, la deficiencia de proteínas agrava la intensidad de las lesiones; en cambio, el aumento en los carbohidratos de la dieta tiene efecto protector; éstas son condiciones artificiales, que probablemente poco tienen que ver con las prevalecientes en cada ser humano.
La glucosa entra al citoplasma mediante un proceso de transporte específico; éste proporciona aproximadamente cien veces la cantidad de carbohidrato que el parásito incorpora por endocitosis, es decir, por los medios inespecíficos empleados para internalizar líquidos y partículas sólidas. El catabolismo de la glucosa difiere considerablemente del de células de mamíferos, ya que los parásitos poseen enzimas glucolíticas poco usuales, que suplen la carencia de mitocondrias, de citocromos y de ciclo del ácido cítrico.
Lo pequeño visto en grande
Visto al microscopio electrónico de transmisión, el citoplasma de las amibas aparece como un conjunto de vacuolas dispuestas en una matriz granular. En amibas obtenidas de casos de disentería, muchas de esas vacuolas contienen glóbulos rojos; en las amibas provenientes de cultivos mixtos se encuentran llenas de almidón o de fragmentos de bacterias. Así pues, parte del aparato vacuolar constituye el aparato digestivo de este protozoario. Sin embargo, la naturaleza y función del sistema vacuolar no ha sido explorado en detalle. En particular, se ha discutido si existen o no lisosomas en las amibas. En células de mamífero, los lisosomas son saquitos envueltos por membrana, con gran diversidad de potentes enzimas hidrolíticas disueltas en el interior, capaces en conjunto de degradar todos los componentes celulares. En las amibas, en cambio, las enzimas hidrolíticas estudiadas están asociadas a la pared interna de la membrana de las vacuolas lisosomales.
Llama la atención la ausencia de mitondrias y de sistemas membranales, semejantes a los que en células eucariónticas típicas integran el complejo de Golgi y el retículo endoplásmico. En vez de ello, se pueden encontrar redes de túbulo y finas vesículas, pero no sabemos si la función de éstos es semejante a la de su contrapartida, mejor estructurada en células diferenciadas.
Los ribosomas —corpúsculos citoplásmicos encargados de la síntesis de proteínas— están agrupados con frecuencia en cúmulos helicoidales; a su vez, éstos forman grandes inclusiones cristalinas de varios micrómetros de longitud, que constituyen los cuerpos cromatoides fácilmente visibles bajo el microscopio ordinario. Estos cúmulos ribosomales, muy poco frecuentes en otros eucariontes, pueden ser reflejo de periodos de actividad metabólica reducida, previa a la diferenciación de trofozoítos a quistes.
Además de los componentes mencionados, el citoplasma de las amibas muestra, al examen ultramicroscópico, un confuso conglomerado de inclusiones de naturaleza desconocida. Los más frecuentes y regulares son las llamadas rosetas, estudiadas por Feria y Treviño, en las que partículas, en todo semejantes a los rabdovirus —uno de ellos es el virus de la rabia—, rodean un agregado de material granular. Estos posibles virus, así como otros que se han logrado identificar con cierta precisión, ocupan el papel de huéspedes inocuos; todos los esfuerzos realizados por demostrar que alguno de los diversos virus amibianos tienen relación con la virulencia del parásito han sido, hasta ahora, infructuosos.
El núcleo desconocido
Aunque casi nada se sabe acerca de la organización estructural y funcional del núcleo de la E. histolytica, su morfología ha servido de base para la identificación de esta especie durante muchas décadas de trabajo en los laboratorios clínicos. Los microscopistas han puesto tal atención en estas estructuras nucleares que han llegado a analizar componentes inexistentes, por la sencilla razón de que sus dimensiones están por debajo del límite de resolución de la microscopía de luz; ello no impide que sigan apareciendo en forma prominente en libros de texto y de consulta de parasitología.
El mecanismo de la división celular es uno de los fenómenos menos estudiados de la biología del parásito; sólo conocemos con seguridad que la división nuclear se realiza sin pérdida de la membrana nuclear. Dobell estaba en duda en 1928 sobre el origen y el número de los cromosomas amibianos. En este asunto no hemos superado a nuestro misántropo investigador inglés; seguimos exactamente en las mismas.
Como si la naturaleza se hubiera empeñado en hacer de la amiba una célula aberrante, la disposición de los componentes nucleares es verdaderamente insólita. Lo que en eucariontes típicos es cromatina periférica, rica en ADN, en las amibas representa sitios de condensación de ARN. De la misma forma, lo que parece ser el nucleolo de las células eucariontes, rico en ARN, en los trofozoítos es un sitio de condensación de ADN, en el que, al parecer, se forman los cromosomas "funcionales", ya que no se diferencian morfológicamente como tales en las amibas. La doble membrana nuclear es distinta de la usual en eucariontes, porque posee una gran cantidad de poros nucleares, reflejo probable de un intercambio muy activo entre núcleo y citoplasma.
Durante la división nuclear aparecen microtúbulos, únicos componentes bien definidos en esta fase de la multiplicación celular. Por último, con gran frecuencia se observan en el núcleo los cuerpos birrefringentes que llamaran la atención de Lesh hace más de cien años y de los cuales sabemos tanto como el famoso ruso, es decir, nada, aparte de que existen.
Uno de los secretos más celosamente guardados de la amibiasis es que el ciclo de vida de la E. histolytica en el ser humano no ha sido estudiado, ya que el único análisis detallado sobre el tema fue llevado a cabo por Dobell, en 1928, mediante cultivos de una cepa amibiana obtenida de un mono. Nada ha sido añadido a la descripción de Dobell; él analizó el ciclo de vida con base en cuatro formas sucesivas: el trofozoíto, el prequiste, el quiste y la amiba metacística. Los trofozoítos se multiplican en la luz intestinal por división binaria y se enquistan, produciendo a su vez quistes cuadrinucleados después de dos divisiones sucesivas del quiste uninucleado. De cada quiste maduro escapa, al parecer, una amiba cuadrinucleada, que después de dividirse forma ocho trofozoítos uninucleados.
¡Cuidado con los quistes!
Uno de los campos en los que nuestra ignorancia es más evidente en relación a la biología de la amibiasis es el proceso de diferenciación de trofozoítos a quistes. El quiste es la forma de resistencia responsable de la transmisión de la infección; por ello es sorprendente y frustrante considerar la poca atención dedicada al estudio de este asunto. Buena parte de ello se debe a nuestra incapacidad para producir enquistamiento de E. histolytica en cultivo, lo que puede lograrse con otra amiba, la E. invadens, parásito de reptiles, entre los que, curiosamente, provoca epidemias de disentería y absceso hepático que diezman de cuando en cuando a reptiles de zoológicos. Lo poco que sabemos del proceso de enquistamiento ha sido estudiado en esta amiba de reptiles.
La pared de los quistes de la E. invadens, a diferencia de la de los quistes de amibas de vida libre, constituidos principalmente de celulosa, están estructuradas a base de quitina, tal como lo ha demostrado Arroyo-Begovich y Cárabez-Trejo. La quitina es un polímero de acetilglucosamina comúnmente encontrado en hongos, crustáceos e insectos, pero ausente en el hombre; por ello, la inhibición específica de las síntesis de la pared del quiste con agentes químicos que interfieran con la formación de la pared, sin alterar el metabolismo del huésped, podría representar un método alterno de control biológico. En este sentido, los resultados iniciales de Avron en Israel son promisorios.
En cuanto a la fase final de la maduración de los quistes, el excistamiento o salida de las amibas del quiste maduro, nada se sabe excepto por la descripción morfológica del proceso hecha por algunos microscopistas acuciosos.
En conclusión, los diez últimos años han sido testigos de una verdadera explosión en el conocimiento de la biología de la E. histolytica. Algunos de esos resultados han servido para aclarar temas básicos de la epidemiología de la enfermedad, como la diferenciación entre cepas patógenas y no patógenas; otros han mejorado la comprensión del parásito como un eucarionte rudimentario en su organización, pero eficaz en su capacidad de sobrevivir.
La amibiasis, enfermedad que a fin de cuentas padecen sobre todo los pobres, había sido relegada al olvido y, con ella, las amibas que la producen. Ese inusual parásito ha resultado ser una célula excepcionalmente interesante; al mismo tiempo que el biólogo celular indaga su estructura, su metabolismo y su funcionamiento, aprende no sólo nuevos hechos que permiten comprender mejor la enfermedad, sino que descubre asimismo el misterio de una nueva y más primitiva organización celular eucarióntica, que permite abordar con precisión el estudio de procesos celulares fundamentales, como la movilidad celular y la fagocitosis.
Bibliografía
- E. Beltrán, Notas de historia protozoológica. IV. "Las amibas parásitas", Anales de la Sociedad Mexicana de Historia de la Ciencia y de la Tecnología (México) 4: 259-308, 1974.
- H. Brandt, R. Pérez-Tamayo, Amibiasis, La Prensa Médica Mexicana, México, 1970.
- C. Dobell, The Amoebae Living in Man. A Zoological Monograph, John Bale, Sons & Danielsson, Londres, 1919.
- A. Martínez-Palomo, The Biology of "Entamoeba histolytica", Research Studies Press/John Wiley, Chichester, 1982.
- A. Martínez-Palomo (editor), Amibiasis, Editorial Médica Panamericana, México, 1989.
* El doctor Adolfo Martínez Palomo es hijo y nieto de científicos. Es medico cirujano de la Facultad de Medicina de la UNAM, maestro en ciencias de la Universidad Queen's de Canadá y doctor en ciencias por la Facultad de Medicina de la UNAM. Su bibliografía en artículos y libros publicados en México y el extranjero es abundante y, además de su preocupación por las amibas, se dedica a estudiar la patología del cáncer y la biología celular del corazón entre otros muchos intereses. En 1986 se le concedió el Premio Nacional de Ciencias El doctor Adolfo Martínez Palomo es miembro de El Colegio Nacional y actualmente es presidente de la Academia de la Investigación Científica.
Fuente: La información fue tomada del libro en línea Las amibas, enemigos invisibles (Primera edición, 1987. Sexta reimpresión, 1996) del Fondo de Cultura Económica, y cuya edición electrónica estuvo a cargo del Instituto Latinoamericano de la Comunicación Educativa (ILCE).
 Muy Interesante / 27/02/2012
Muy Interesante / 27/02/2012.JPG)